- 인공지능(AI) 활용, 암세포별 최적 항암제 조합과 투여 농도 제시
- 환자 개인별 특성 고려한 맞춤형 항암 치료 가능 확인
- 논문, SCI급 국제학술지'Briefings in Bioinformatics'게재
[위즈뉴스] 국내 연구진이 AI 기반의 복합 항암제 예측 모델을 개발해 정밀 항암 치료에 대한 새로운 가능성을 제시했다.
광주과학기술원(GIST, 총장 임기철)은 3일, 전기전자컴퓨터공학과 남호정 교수 연구팀이 암세포별 항암제의 조합과 투여 농도를 정밀하게 예측할 수 있는 인공지능(AI) 복합 항암제 예측 모델을 개발했다고 밝혔다.
이번 연구는 암세포마다 다르게 나타나는 약물 반응을 AI로 분석하여 최적의 항암제 조합과 투여 농도를 제시함으로써 환자 개인별 특성을 고려한 정밀 항암 치료를 가능하게 할 것으로 기대된다

이번 연구 성과를 담은 논문은 SCI급 국제학술지 '브리핑스 인 바이오인포매틱스(Briefings in Bioinformatics, IF=7.9)' 1월 12일 자 온라인 게재됐다.
논문명은 'DD-PRiSM: a deep learning framework for decomposition and prediction of synergistic drug combinations'이며, 남호정 교수가 교신저자로, 진일중 석박통합과정생과 이송연 박사과정생, 마틴 슈무할렉(Martin Schmuhalek) 석박통합과정생이 공동 제1저자로 참여했다.
"맞춤형 항암 치료의 정확도를 한층 높일 것"
연구팀의 남호정 교수는 이번 연구의 성과와 관련해 “맞춤형 항암 치료의 정확도를 한층 높일 것”이라며 "특히, 복합 항암제의 투여 농도까지 정밀하게 예측할 수 있어 임상적 활용도가 매우 클 것으로 기대한다”고 말했다.

doi.org/10.1093/bib/bbae717
복합 항암제 치료(combination therapy)는 두 가지 이상의 항암제를 조합해 사용하는 치료법으로, 단일 항암제 치료에 비해 시너지 효과가 크고 독성이 낮으며 약물 내성을 극복할 수 있다는 장점이 있다.
하지만 조합이 잘못될 경우 오히려 강한 독성이나 길항작용에 의한 길항효과를 초래할 수 있어 최적의 조합을 정확히 예측하는 것이 중요하다. 길항효과(antagonistic effect)란 2개 이상의 약물을 함께 처방하였을 때, 약물간 상호작용으로 인해 각 약물을 단독 처방한 것보다 낮은 효능을 가지는 현상을 의미한다.
AI 기반의 복합 항암제 효능 예측 연구는 방대한 약물을 대상으로 최적의 조합 결과를 효율적으로 탐색하는 것이 목적이다. 기존 연구에서는 유전자 발현량과 같은 암세포 표현자와 약물 특성 데이터를 연결하여 심층 신경망의 입력 데이터로 사용함으로써 복합 항암제의 시너지 효과를 예측했다.
그러나 이러한 접근법은 두 가지 한계를 보였다. 첫째, 단일 항암제와 복합 항암제 간의 직접적 연관성을 고려하지 않았다. 둘째, 약물의 실제 투여 농도를 반영하지 못하고 평균적인 상승 효과만 예측했기 때문에 효과적인 복합 항암제를 찾아내더라도 구체적인 투여 용량을 제시하지 못했다.
이러한 문제를 해결하기 위해 연구팀은 임의의 암세포, 약물, 약물 농도에 대해 복합 항암제의 효능 및 상호작용을 높은 정확도로 유추할 수 있는 복합 항암제 약효 예측 모델(DD-PRiSM: A Deep Learning Framework for Decomposition and Prediction of Synergistic Drug Combinations)을 개발했다.
이 모델은 암세포의 유전자 발현량과 단일 항암제의 구조 정보를 활용하여 암세포와 단일 항암제 사이의 약물 메커니즘과 약물 반응 곡선을 분석·예측한 후, 주어진 농도에서 각 단일 항암제의 효능과 약물 메커니즘을 이용하여 단일 항암제 2개를 결합한 복합 항암제의 시너지 효과와 각 단일 항암제의 영향력을 예측함으로써 복합 항암제의 효능을 계산한다.
이번 연구 성과는 임의의 세포주·약물·약물 농도에 대해 효능을 예측할 수 있다는 장점이 있다.
암세포에 대한 복합 항암제의 효능이나 시너지효과는 각 항암제의 농도에 따라 달라지게 되는데, 모든 농도에서의 평균값을 예측하는 기존 연구들은 농도에 따른 시너지효과의 변화를 예측할 수 없다.
또한 학습 과정에서 다루지 않은 암세포-복합 항암제 조합에 대해서도 피어슨 상관계수 0.9063의 높은 성능을 보였으며, 동일 조건에서 또 다른 농도 의존적 복합 항암제 효능 예측 모델인 IDACombo와 비교하였을 때, 평균 제곱근 오차는 8.37% 개선되었다.
피어슨 상관계수(Pearson correlation coefficient)란, 통계학에서 두 변수 간 선형 관계의 정도를 측정하는 데 사용되는 방법으로, -1에서 +1 사이의 값을 가지며 그 값이 +1에 가까울수록 완벽한 양의 선형 관계를, -1에 가까울수록 완벽한 음의 선형 관계를 의미한다. 0에 가까우면 두 변수 사이에 선형 관계가 없음을 나타낸다.
평균 제곱근 오차(Root Mean Squared Error)는 통계학 혹은 기계학습에서 추정값이 실제 값과 얼마나 차이가 나는지를 측정하는 지표로, 값이 작을수록 예측이 정확한 것을 의미한다. IDACombo는 복합 항암제의 효능을 설명하는 모델 중 하나인 Independent Drug Action 모델에 근거하여 복합 항암제의 효능은 복합 항암제를 구성하는 두 단일 항암제 중 효능이 큰 쪽의 효능과 같다는 가정을 통해 복합 항암제의 효능을 계산한다.
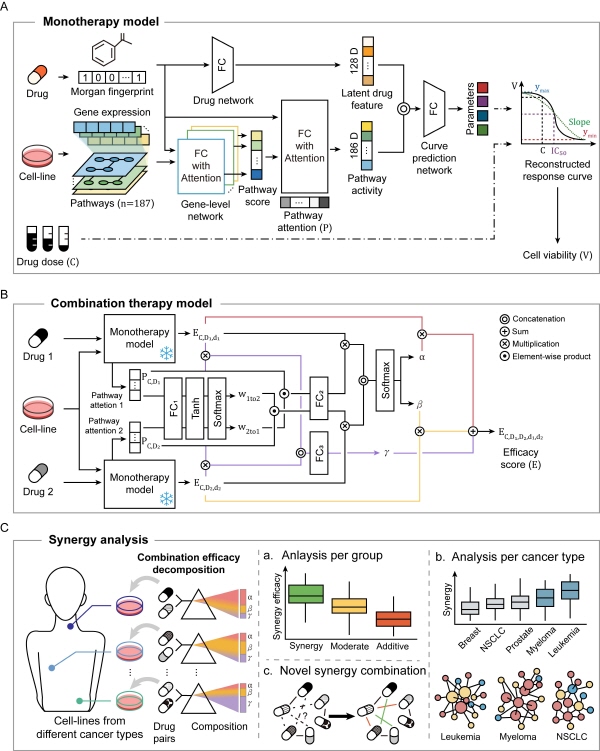
[그림설명] DD-PRiSM 연구 개요
연구를 구성하는 2개 인공지능 모델과 이를 이용한 분석 방법을 보여주고 있다.
연구팀은 시너지 효과가 강한 복합 항암제는 시너지 효과가 약한 복합 항암제에 비해 표적 항암제를 포함하고 있는 비율이 높다는 사실도 확인했다.
예측된 시너지 효과에 근거하여 각 복합 항암제를 시너지 효과를 기준으로 높음/중간/낮음의 3가지 그룹으로 분류하고 분석한 결과, ‘높음’ 그룹(56.58%)이 다른 그룹(중간:40.52%, 낮음:35.96%)에 비해 표적 항암제를 포함하는 복합 항암제가 많았다.
표적 항암제는 암세포가 가진 특정 마커(marker)만을 판별하여 공격하기 때문에 정상 세포를 건드리지 않고, 세포독성 항암제에 비해 암세포 살상력도 몇 배나 뛰어나다.
연구팀은 또한 AI 모델을 통해 암종별 시너지 효과가 발생하는 정도가 다른 것을 확인하였으며, 각 암종에 대해 유력한 복합 항암제 및 농도 조합을 제시했다.
그 결과, 혈액암이 고형암보다 시너지 효과가 높게 예측된 것을 확인했는데 특히 혈액암은 소수의 항암제가 시너지 효과를 주도하는 것에 반해 고형암은 다수의 항암제들이 각각 소수의 다른 항암제와 시너지 효과를 냈다.
연구팀은 암종에 따라 적게는 41쌍의 복합 항암제(전립선암)를, 많게는 417쌍의 복합 항암제(골수종)를 제시하여 총 2,556쌍의 유력 복합 항암제를 제시하였으며, 특히 다발성 골수종 세포인 RPMI-8226에 대해 보르테조밉과 아자시티딘 조합은 시너지 효과가 높아 항암 효과 또한 클 것으로 파악했다.
보르테조밉(bortezomib)은 다발성 골수종 및 일부 림프종 치료에 효과적인 약물로서 최근 암 치료 분야에서 주목받고 있다. 이 약물은 단백질 분해 효소인 프로테아좀을 억제함으로써 종양 세포의 생존과 분열을 방해하는 방식으로 작용한다.
아자시티딘(Azacitidine)은 최근 암 치료의 새로운 가능성을 열어주는 혁신적인 약물로 주목받고 있으며, 주로 혈액암 특히 급성 골수성 백혈병(AML)과 전골수종 치료에 사용되며 세포의 DNA 메틸화 상태를 조절하여 암세포의 성장과 생존을 억제하는 역할을 한다.
이번 연구는 과학기술정보통신부와 한국연구재단 초고성능컴퓨팅 활용 고도화 사업, 한국산업기술진흥원 중견기업 DNA 융합 산학협력 프로젝트의 지원을 받았다.


